
Gb5

Gb4
Gb3

Gb2
Mata Kuliah : Kimia Terapan
Dosen : DR. Mudjiyono
Th Heni Ambaristi
S830208024/psains/IPA
I. Pendahuluan
Mengapa elektroplating diperlukan?
Kehidupan masyarakat modern tidak bisa terlepas dari benda-benda yang dibuat dengan proses elektroplating. Komponen dan aksesori kendaraan bermotor, aksesori mebel, kursi lipat, berbagai alat perkantoran, alat-alat pertanian, jam tangan, aksesori rumah tangga, perhiasan dan berbagai alat-alat industridilakukan pengerjaan akhir melalui proses electroplating. Elektroplating ditujukan untuk berbagai keperluan mulai dari perlindungan terhadap karat seperti pada pelapisan seng pada besi baja yang digunakan untuk berbagai keperluan bahan bangunan dan konstruksi. Pelapisan nikel dan krom umumnya ditujukan untuk menjadikan benda mempunyai permukaan lebihkeras dan mengkilap selain juga sebagai perlindungan terhadap korosi.
Elektroplating (electroplating) atau lapis listrik atau penyepuhan merupakan salah satu proses pelapisan bahan padat dengan lapisan logam menggunakan bantuan arus listrik melalui suatu elektrolit. Benda yang dilakukan pelapisan harus merupakan konduktor atau dapat menghantarkan arus listrik. Masyarakat umum lebih mengenal istilah-istilah veerzinc, veernickel, veerchrom untukpelapisan seng, nikel maupun krom daripada istilah elektroplating, sehingga bila kita membicarakan hal elektroplating masih banyakyang belum memahami dengan jelas. Sedangkan istilah
II. Dasar Teori
A. Sel Elektrolisis
Berlawanan dengan elektrokimia yang memanfaatkan reaksi redoks spontan untuk menghasilkan energi listrik, maka elektrolisis memanfaatkan energi listrik untuk menjalankan reaksi redoks yang tidak spontan. Sel elektrolisis merupakanperangkat yang digunakan dalam proses elektroli
sis tang terdiri dari sumber arus searah, electrode positif dan negative. Zat yang dielektrolisis merupakan elektrolit, baik berupa larutan atau cairan (leburan) zat murni. Bila suatu cairan atau larutan elektrolit dialiri listrik arus searah melalui batang electrode, maka ion-ion yang ada dalam cairan atau larutan tersebut akan bergerak menuju electrode yang berlawanan muatannya. (Sudarmo, Unggul , 2007:46).
Dalam peristiwa elektrolisis, reaksi yang tidak spontan dijalankan dengan menambah energi (arus listrik) untuk mendorong agar reaksi terseburdapat berjalan. Oleh karena itu, zat hasil reaksi di kutub positif (anode) ditentukan oleh zat-zat apa yang ada di sekitar anode yang paling mudah mengalami oksidasi, bahkan anodenya sendiri dapat mengalami oksidasi, sedangkan reaksi yangterjadi pada katode tergantung zat apa yang paling mudah direduksi di katode.
Berdasarkan hal tersebut maka reaksi yang terjadi pada sel elektrolisis dipengaruhi oleh beberapa faktor yaitu :
1. Bahan elektrode
Bila bahan electrode terbuat dari grafit ( C ) atau logam inert ( misalnya Pt atau Au ) maka electrode tidak mengalami oksidasi atau reduksi. Jadi yang mengalami oksidasi atau reduksi spesi-spesi yang ada di sekitar electrode. Bila elektrodenya ( terutama anode) dari logam aktif maka anode tersebut akan mengalami oksidasi.
2. Ion-ion di sekitar elektrode
Ion-ion yang mempunyai potensial electrode standar (Eo) yang lebihpositif mengalami reaksi lebih dulu (lebih mudah mengalami reduksi).
B. Reaksi yang terjadi di anode dan katode
Reaksi yang terjadi di anode merupakan reaksi oksidasi. Olehkarena itu, dalam sel elektrolisis anode merupakan electrode positif. Jika elektrode positif itu terdiri atas logam inert, misalnya Au, Pt, atau grafit, electrode tidak teroksidasi. Secara umum, logam yang tidak teroksidasi itu memiliki potensial oksidasi lebihbesar daripada air dan anion sisa asam. Jika electrode terdiri atas logam inert, reaksi oksidasi yang terjadi di anode bergantung pada jenis anion dalam larutan. Jika anion itu memiliki potensial oksidasi lebih besar daripada air, seperti ion Br- dan I-, atau
Reaksi di katode merupakan reaksi reduksi. Reaksi itu bergantung pada jenis kation yang ada dalam larutan. Jika kation merupakan logam aktif, seperti logam golongan IA, IIA, Al, atau Mn, air akan tereduksi. Hal ini terjadi karena semua logam itu memiliki potensial reduksi lebih kecil daripada air. (Susilowati, Endang, 2004:53 )
III. Pembahasan
A. Elektrolisis
Arus elektrik mengalir di dalam konduktor elektrik seperti logam dan karbon.Tetapi tidak ada apa-apa berlaku kepada konduktor tersebut.Tetapi apabila sejenis lagi konduktor yaitu elektrolit seperti kuprum klorida dialiri oleh arus elektrik, tenaga elektrik ini akan menyebabkan bahan tersebut terurai secara kimia. Proses tersebut dinamakan elektrolisis.yang bernama proses penguraian secara kimia oleh bahan elektrolit yang disebabkan oleh pengaliran arus lektrik. Elektrolit merupakan bahan ionik yang berada dalam keadaan liqud atau cair, leburan atau dalam keadaan larutan. Pada ketika itu bahan ionik bebas didalam bentuk ion-ion yang bermuatan .Ion terdiri dari kation yang bermuatan positif dan anion yang bermuatan negatif. Apabila elektroda dibekalkan dengan sumber elektrik arus terus, salah satu terminal menjadi katoda dan yang lain menjadi anoda. Katoda ialah elektroda yang kaya dengan elektron ( negatif) manakala anoda terminal yang kekurangan elektron( positif). Ion-ion akan bergerak kearah elektroda yang bertentangan cas. Kation akan ke katoda manakala anion akan bergerak ke anoda.
PERLAKUAN DI KATODA
Katoda merupakan elektroda yang disambung dengan puncak negatif sumber elektrik.Oleh itu ia mengandungi banyak elektron-elektron.Kation pula merupakan atom-atom ( biasanya logam ) bebas yang kekurangan elektron dan bermuatan positif.
Oleh karena berlawanan cas, kation akan bergerak ke katoda. Di situ, elektron-elektron yang banyak akan diberi kepada kation untuk memenuhi kekurangan elektron padanya.Apabila kation mendapat elektron ia menjadi neutral dan bersifat bahan atom.Biasanya dalam elektrolisis bahan atom akan melapisi katoda atau akan termendap kebagian bawah sebagai hasil penguraian.
PERLAKUAN DI ANODA
Anoda disambungkan kepada puncak positif bateri. Oleh itu tindakan bateri menyebabkan banyak elektron dari anoda telahdi hantar ke katod.Maka itu ia kekurangan elektron dan bercas positif. Manakala anion pula ialah atom-atom atau molekul-molekul bebas yang bercas negatif. Anion mempunyai kelebihan elektron padanya.Karana berlawanan cas, anion akan bergerak ke anoda.Disana ia akanmengeluarkan elektron lebihan tersebut ke anoda.Anion akan menjadi neutral dan menjadi atom-atom.Biasanya ialah bahan bukan logam.Pada proses elektrolisis, selepas anion menjadi neutral, ia boleh bergabung untuk membentuk bahan-bahan molekul sebagai hasil elektrolisis.
Gambar 1 : elektrolisis
Tabel 1 : Contoh elektrolisis
| Elektrolit | Katoda | Anoda |
| kuprum(ii)klorida | klorin | kuprum |
| air | hidrogen | oksigen |
| larutan natrium klorida | hidrogen | klorin |
Gambar 2 : Tindakan Di Katoda
B. Aplikasi Elektrolisis
1. Rangkaian eksternal, terdiri atas : sebuah sumber arus DC, medium penyalur arus ke bak plating, instrumentasi lain seperti ammeter, voltmeter, dan regulator arus atau tegangan.
2. Elektroda negatif atau katoda (yang merupakan bahan yang akan dilapisi), dan media untuk menempatkan elektroda dalam bakplating
3. Larutan plating, umumnya berbentuk cairan.
4. Elektroda positif atau anoda (yang merupakan logam yang dilapiskan), dapat juga berupa logam yang inert dan tidak larut .
Kegunaan Plating
Kegunaan elektroplating ada empat tujuan utama yaitu penampilan, perlindungan, sifat khusus, sifat mekanis. Keempat kegunaan ini kadang sulit dipisahkan satu sama lain, umumnya untuk satu proses elektroplating memiliki dua atau lebih dari keempat fungsi tersebut.
1. Dekoratif. Banyak logam tidak menarik untuk dilihat, karena memiliki sifat mudah teroksidasi, berminyak, atau berkarat. Contohnya seperti besi, yang merupakan logam paling murah yang tersedia banyak di pasaran Lapisarf tipis krotft akan mempercantik penampilan sekaligus menambah nilai jual dari seng. Krom dapat di-plating dengan proses 'bright plating dan terlihat mengkilat (bila dilakukan dengan benar dapat bertahan hingga bertahun-tahun). 01eh sebab ini maka krom plating menjadi plating paling banyak digunakan selama ini untuk tujuan dekoratif. Namun karena krom plating sendiri sangat tipis (untuk membuat lapisan kromium dengan ketebalan tertentu sangat sulit, terutama karena kesulitan dalam pengukuran ketebalan) maka digunakan kombinasi tembaga-nikel atau nikel saja sebagai undercoat (lapisan bawah) kromium, sehingga hasil plating dapat bertahan lebih lama. Logam lain yang digunakan untuk dekoratif plating antara lain emas, perak, tembaga, perunggu, kuningan, dan rhodium.
2. Protektif. Fungsi plating untuk lapisan pelindung seringkali dihubungkan dengan fungsi plating untuk dekoratif. Kombinasi tembaga nikel- kromium yang digunakan untuk bumper mobil, contohnya, mempunyai dua fungsi, yaitu melindungi dari karat dan mempercantik penampilan mobil. Khusus untuk fungsi proteksi, seng adalah logam yang paling ekonomis dan efektif yang paling banyak digunakan. Walaupun seng dapat dikilapkan, namun tidak akan bertahan lama, akibatnya seng jarang digunakan untuk fungsi dekoratif. Kadmium lebih mahal dari seng, namun memiliki sifat jauh lebih unggul daripada seng, kadmium lebih tahan korosi terutama bila digunakan pada lingkungan yang lembab atau di laut. Tin (timah) berfungsi untuk melindungi besi terutama pada kaleng makanan. Sebenarnya kombinasi fungsi timah dan besi adalah saling melengkapi, dimana besi menguatkan sifat timah yang mudah penyok, dan timah melindungi besi dari karat, sekaligus melindungi makanan dari besi. Kaleng makanan merupakan penerapan proses elektroplating dalam jumlah besar yang paling banyak digunakan oleh industri.
3. Sifat khusus.
- Timah dilapiskan pada kaki komponen elektronik untuk mempermudah solder melekat padanya. Kaki komponen terbuat dari tembaga, namun tembaga saja tidak cukup cepat dilekati timah
- sambung, diperlukan tahanan yang sangat kecil pada kontak. Logam emas di solder karena sangat sulit menjaga tembaga dari lapisan film yang ditimbulkannya akibat interaksi dengan lingkungan. Lapisan minyak ini akan empersulit pelekatan timah solder pada kaki komponen.
- Untuk fungsi reflektor (pada senter, atau lampu otomotif), logam dilapisi dengan logam perak atau rhodium yang memiliki daya refleksi tinggi.
- Untuk fungsi relay dan switch yang bekerja dengan kontak putusan palladium dilapiskan pada kontak untuk memperkuat fisik kontak dan memperkecil tahanan kontak.
4. Sifat mekanik. Kategori ini dapat digolongkan pada pemberian sifat khusus pada logam dasar. Kategori ini dipisah dengan pertimbangan bahwa untuk penggunaan mekanik, sebuah logam perlu dilapisi lebih tebal dibanding dengan tiga kategori sebelumnya, seringkali hingga orde milimeter ( tiga kategori sebelumnya hanya hingga orde mikrometer ). Umumnya sifat flsik yang diinginkan dalam kategori ini adalah kekuatan dan ketahanan. Terkadang plating digunakan untuk merekonstruksi ulang
bentuk dari logam yang telah rusak baik akibat penggunaan maupun salah produksi. Kromium dengan ketebalan jauh di atas ketebalan untuk fungsi dekoratif, digunakan untuk melapisi laras senapan, membentuk gilingan yang digunakan dalam mesin pembuat kertas, silinder mesin diesel, dan banyak benda-benda lain yang membutuhkan kekerasan bahan. Klaker untuk roda pintu besi harmonika, roda kendaraan, atau mencairkan tip-ex semuanya terendam dalam cairan, yang mana mudah terjadi korosi, sehingga dilapisi dengan kromium untuk meningkatkan daya tahan korosi.
C. Larutan yang digunakan dalam elektroplating
Setiap larutan plating yang digunakan mengandung beberapa bahan yang mempunyai fungsi sebagai berikut:
1. Menyediakan logam yang dilapiskan
2. Membentuk kompleks dengan logam pelapis
3. Bersifat konduktif
4. Mampu menstabilkan larutan (dari hidrolisis)
5. Mampu menjadi buffer (menstabilkan pH)
6. Memodifikasi bentuk fisik lapisan
7. Membantu melarutkan anoda
8. Memodifikasi sifat-sifat lain dari larutan (tergantung pada larutannya
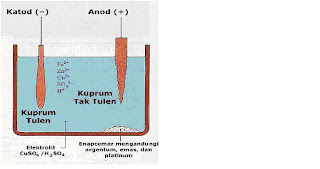
Gambar 3 : Penulenan Cuprum
D. Pemanfaatan Au3+ dalam electroplating perhiasan yang berlapis emas
· Logam yang hendak disadur dijadikan katod.
· Loram penyadur dijadikan anoda.Garam logam penyadur dijadikan elektrolit.
· Logam yang disadur lebih reaktif dari logam penyadur dalam siri elektrokimianya.
Tabel 2 : Logam penyadur, logam disadur, dan tujuan
| Logam Penyadur | Logam disadur | Tujuan |
| Emas | Barang Kemas | Mencantikan |
| Kromium | Bahagaian kenderaan | Mencegah kakisan |
| Nikel | Syiling | Mencantikan |
| Perak | Barang cendermata | Mencantikan |
| Timah | Tin makanan | Mencegah kakisan |
Gambar 4 : proses penyaduran
Pembuatan perhiasan yang berlapis emas menggunakan cara elektrolisis untuk pelapisannya. Perhiasan yang akan dilapisi (disepuh) diletakkan pada katode dan logam emas yang untuk menyepuh diletakkan di anode, sedangkan elektrolitnya merupakan larutan yang mengandung ion Au3+. Larutan Au3+ harus dibuat dengan konsentrasi yang sekecil-kecilnya dan menggunakan arus yang sekecil-kecilnya agar proses penempelannya sempurna. Bila penempelannya terlalu cepat proses kristalisasinya tidak sempurna dan akibatnya menjadi hitam (tidak mengkilat). Agar konsentrasi Au3+ yang ada dalam larutan sekecil-kecilnya maka garam Au3+ ditambah apotas (K2CO3.KCN) yang akan membentuk ion kompleks [ Au(CN)6]3-. Proses penyepuhan memerlukan ketrampilan dan pengalaman, sebab tanpa latihan hasil yang didapat tidak baik.
Gambar 5 : Contoh Perhiasan yang disepuh emas
IV. Kesimpulan
Salah satu aplikasi elektrolisis adalah dalam proses penyepuhan ( electroplating ). Untuk melakukan proses elektroplating dibutuhkan empat komponen, yaitu :
1. Rangkaian eksternal, terdiri atas : sebuah sumber arus DC, medium penyalur arus ke bak plating, instrumentasi lain seperti ammeter, voltmeter, dan regulator arus atau tegangan.
2. Elektroda negatif atau katoda (yang merupakan bahan yang akan dilapisi), dan media untuk menempatkan elektroda dalam bakplating.
3. Larutan plating, umumnya berbentuk cairan.
4. Elektroda positif atau anoda
Pembuatan perhiasan yang berlapis emas menggunakan cara elektrolisis untuk pelapisannya. Perhiasan yang akan dilapisi (disepuh) diletakkan pada katode dan logam emas yang untuk menyepuh diletakkan di anode, sedangkan elektrolitnya merupakan larutan yang mengandung ion Au3+. Larutan Au3+ harus dibuat dengan konsentrasi yang sekecil-kecilnya dan menggunakan arus yang sekecil-kecilnya agar proses penempelannya sempurna. Bila penempelannya terlalu cepat proses kristalisasinya tidak sempurna dan akibatnya menjadi hitam (tidak mengkilat). Agar konsentrasi Au3+ yang ada dalam larutan sekecil-kecilnya maka garam Au3+ ditambah apotas (K2CO3.KCN) yang akan membentuk ion kompleks [ Au(CN)6]3-. Proses penyepuhan memerlukan ketrampilan dan pengalaman, sebab tanpa latihan hasil yang didapat tidak baik.
Daftar Pustaka
Sudarmo, Unggul. 2007. Kimia Untuk SMA/MA Kelas XII. Jakarta : Phibeta Aneka Gama
Susilowati, Endang. 2004. Sains Kimia. Solo : Tiga Serangkai Pustaka Mandiri
Suyatno,dkk. 2007. Kimia untuk SMA/MA Kelas XII. Jakarta : Grasindo
Elektroplating :
jiunkpe/s1/elkt/2002/jiunkpe-ns-s1-2002-23498094-1297-electroplating-chapter2.pdf
Elektroplating Emas :
cybershopping.cbn.net.id/cbprtl/common/ptofriend.aspx?x=Hot+Topic&y=cybershopping%7C0%7C0%7C4%7C118 - 18k
Teknologi Industri Elektroplating :
www.matzakaria.com/kuliah/stkk1113/kuliah41/kuliah41.html - 13
Aplikasi Elektrolisis :
www.pspnperak.edu.my/kimia45/tingkatan4/salwani/BBM/NOTA%20ELEKTROLISIS%202.doc


